Die FDA erteilt Suzhou CH Biomedical die Genehmigung für den Beginn klinischer Studien für das linksventrikuläre Assistenzsystem BrioVAD™, das innovative Lösungen für Herzinsuffizienz verspricht.


Kürzlich gab Suzhou CH Biomedical, Inc. bekannt, dass ihr eigenständig entwickeltes, vollständig magnetisch gelagertes linksventrikuläres Unterstützungssystem der nächsten Generation, BrioVAD™, die Zulassung der US-amerikanischen FDA zur Durchführung klinischer Studien erhalten hat. Die Meilenstein-Klinische Studie, genannt INNOVATE, hat die Investigational Device Exemption (IDE) der FDA erhalten, was die bedingte Aufnahme der Patientenrekrutierung ermöglicht.
Diese Studie wird die Wirksamkeit und Sicherheit von BrioVAD™ bewerten, einem neuen, vollständig magnetisch gelagerten linksventrikulären Unterstützungssystem, das von CH Biomedical zur Behandlung von refraktärer Herzinsuffizienz entwickelt wurde. Unterdessen hat CH Biomedical das erste Prüfertreffen für die Studie einberufen und die entsprechenden Startarbeiten für klinische Prüfzentren in den Vereinigten Staaten initiiert.

▲ CH Biomedical hält erstes Prüfertreffen für die INNOVATE-Klinische Studie ab
Das BrioVAD™-Linksventrikuläre Unterstützungssystem, das von der FDA in den Vereinigten Staaten zugelassen wurde, baut auf der ausgezeichneten Blutverträglichkeit des bestehenden Produkts CH-VAD auf. Durch mehrere technologische Innovationen erreicht es die Tragbarkeit externer Tragekomponenten und verbessert gleichzeitig die Gesamtleistung des Systems weiter. Zusätzlich wird in der INNOVATE-Studie ein randomisiertes kontrolliertes Design verwendet, um BrioVAD™ mit zuvor von der FDA zugelassenen Produkten zu vergleichen und zu bewerten.
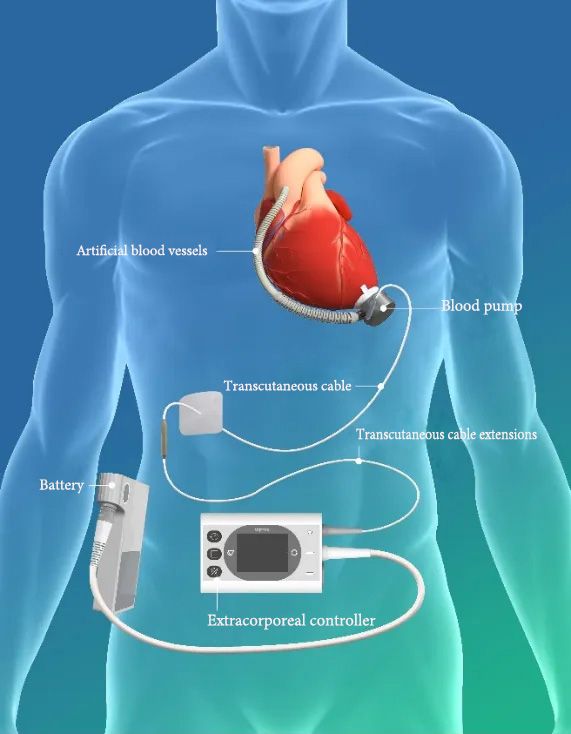
▲ Linksventrikuläres Unterstützungssystem BrioVAD™ Produktschema
CH-VAD ist das erste vollständig magnetisch gelagerte implantierte linksventrikuläre Unterstützungssystem (LVAD), das in China entwickelt wurde. Es wurde gemeinsam vom Team des Fuwai-Krankenhauses und CH Biomedical entwickelt, wiegt 186g, hat einen Blutpumpendurchmesser von 50mm, eine Dicke von 26mm und eine maximale Durchflussrate von 10L/min. Die Kerntechnologie dieses Produkts umfasst hauptsächlich die vollständig magnetisch gelagerte Blutpumpentechnologie, die mehrere Patente in China und den Vereinigten Staaten erhalten hat, was es zu einem inländisch wegweisenden Medizinprodukt macht. Im Vergleich zu ähnlichen internationalen Produkten haben seine Schlüssel-Leistungsindikatoren das gleiche Niveau erreicht, mit kleinerer Pumpengröße und besserer Implantatinvasivität.
CH-VAD ist seit 2018 klinisch verfügbar und erhielt 2021 die NMPA-Zulassung für den Einsatz mit spezifischen künstlichen Blutgefäßen, um die mechanische Unterstützung der Blutzirkulation bei Patienten mit refraktärer Herzinsuffizienz im Endstadium zu gewährleisten. Es wird als Übergangstherapie vor einer Herztransplantation oder zur Wiederherstellung der Herzfunktion eingesetzt.

▲ CH® Implantierbares Linksventrikuläres Unterstützungssystem (CH-VAD)
CH-VAD besteht aus internen Implantatkomponenten, externen Tragekomponenten, Peripheriegeräten und speziellen chirurgischen Werkzeugen. Es ist ein elektromechanisch integriertes Gerät, das teilweise die Herzpumpfunktion ersetzt und die menschliche Blutzirkulation aufrechterhält. Die Kernkomponente ist eine Blutpumpe, die Blut aus dem Herzen zieht, den Druck erhöht und es zur Aorta transportiert, wodurch die Arbeitsbelastung des natürlichen Herzens entlastet und es zur Ruhe gebracht wird, während gleichzeitig die unzureichende Pumpkapazität des natürlichen Herzens ergänzt wird.
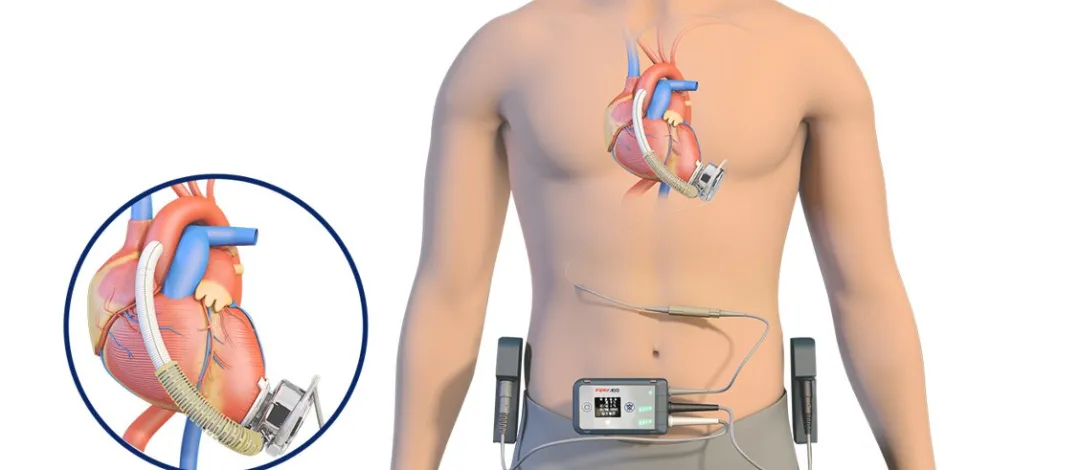
▲ CH® Implantierbares Linksventrikuläres Unterstützungssystem (CH-VAD)
Seit seiner Einführung wurde CH-VAD bei über 180 Patienten in mehr als 40 führenden Herzzentren landesweit eingesetzt. Der erste Patient hat über 6 Jahre überlebt und führt weiterhin ein qualitativ hochwertiges Leben. CH-VAD hat ein vollständiges unabhängiges System der geistigen Eigentumsrechte von Grund auf aufgebaut und Patentschutz in China, den Vereinigten Staaten, Europa, Japan und anderen Ländern und Regionen erhalten.
Im April 2024 präsentierte Professor Xianqiang Wang vom Fuwai-Krankenhaus der Chinesischen Akademie der Medizinischen Wissenschaften auf dem ISHLT-Symposium "Spin Doctors and Heart Hotties: Unleashing the Future of MCS Devices" die Langzeitergebnisse von CH-VAD auf internationaler Bühne. In dieser single-center, retrospektiven, beobachtenden Studie zeigten Patienten mit Endstadium-Herzinsuffizienz, die mit CH-VAD behandelt wurden, hohe Überlebensraten und niedrige Komplikationsraten, ohne Fälle von Pumpenthrombose, behindernden Schlaganfällen oder größeren Geräteausfällen.
Forschungsziele
Um die Langzeiteffizienz und Sicherheit von CH-VAD weiter zu bewerten, führte das Fuwai-Krankenhaus diese single-center, retrospektive, beobachtende Studie durch, die Herzinsuffizienzpatienten einschloss, die von Juni 2017 bis August 2023 mit CH-VAD behandelt wurden, um ihre klinischen Daten und langfristigen Prognosen statistisch zu analysieren.
Forschungsmethoden
Diese Studie umfasste 50 Patienten mit Nachbeobachtungszeiten von 3 Monaten bis 6,7 Jahren. Die durchschnittliche Pumpunterstützungsdauer betrug 2,4 Jahre, und alle 50 Patienten unterzogen sich erfolgreich der LVAD-Implantation. Der Blutpumpenbetrieb der Patienten war sowohl intraoperativ als auch postoperativ stabil, und die Hämodynamik kehrte zur Normalität zurück.
Forschungsergebnisse
Unter Verwendung der Kaplan-Meier-Überlebensanalyse betrugen die 1-Jahres-, 2-Jahres- und 3-Jahres-Überlebensraten der Patienten 93%, 93% und 89%, jeweils höher als in internationalen klinischen Studien und realen Settings. Unter den 50 Patienten wurden nur 2 einer Herztransplantationsüberbrückung unterzogen. Drei Patienten erholten sich vollständig und das LVAD wurde entfernt.
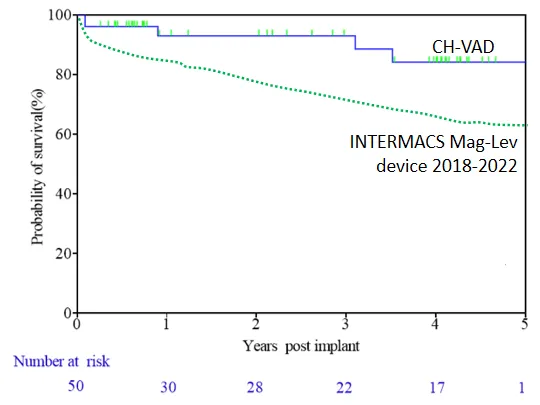
▲ Überleben der Patienten während der Nachbeobachtung
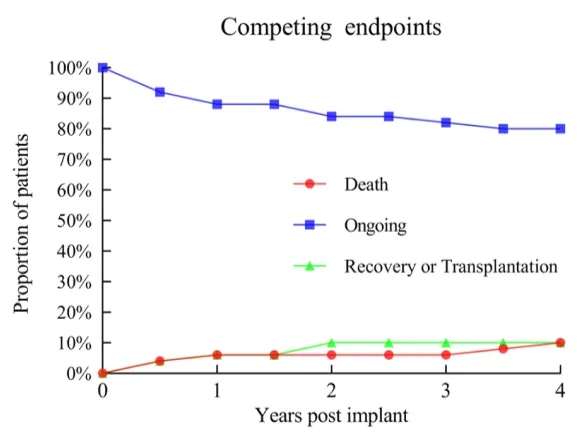
▲ Auftreten von Ereignissen für verschiedene Endpunkte
In dieser Studie war die Gesamtinzidenzrate von unerwünschten Ereignissen gering. Die hervorragende Blutverträglichkeit von CH-VAD zeigte sich, da keine Fälle von Pumpenthrombose, Hämolyse oder behindernden Schlaganfällen beobachtet wurden.
Unter allen Patienten erlitten nur 2 einen ischämischen Schlaganfall (0,02 pro Personenjahr), und 1 erlitt einen hämorrhagischen Schlaganfall (0,01 pro Personenjahr), wobei sich die neurologischen Funktionen aller Patienten während der Nachbeobachtung erholten. Das häufigste unerwünschte Ereignis war eine postoperative Infektion, die durch die Ansammlung von interdisziplinärem Managementwissen effektiv verhindert und kontrolliert wurde, was zu einer guten Prognose für die überwiegende Mehrheit der Patienten führte. Es gab keine größeren Geräteausfälle oder Pumpenersatzoperationen während der Nachbeobachtungszeit, was auf die hohe Langzeitzuverlässigkeit des Geräts hinweist.
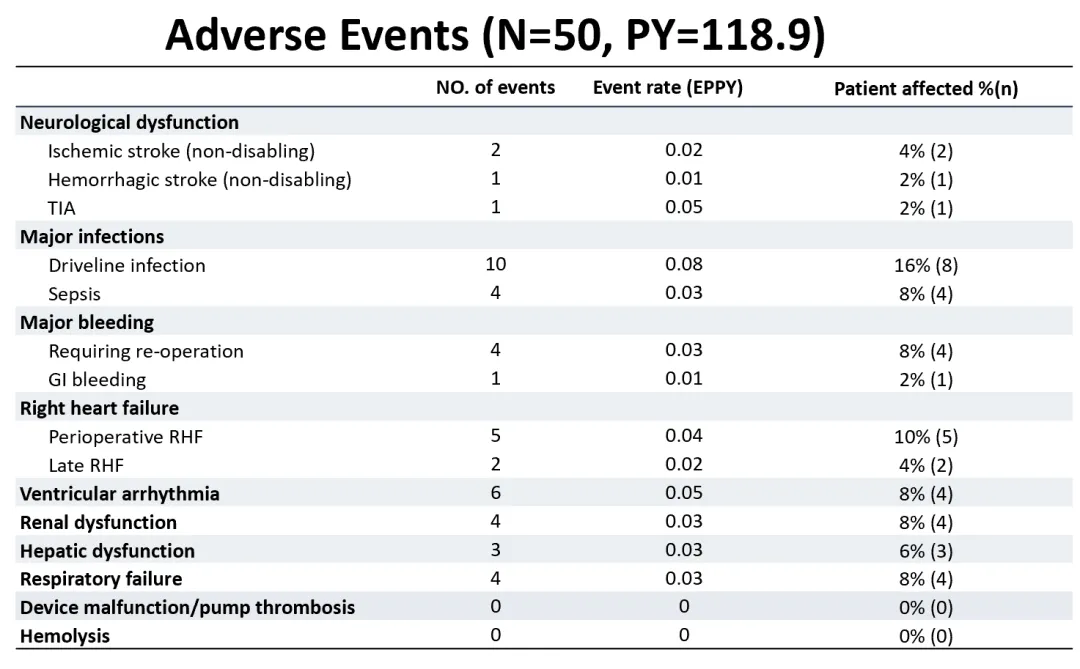
▲ Auftreten verschiedener Arten von unerwünschten Ereignissen
Am 15. April 2024 gab die U.S. Food and Drug Administration (FDA) einen Rückruf der implantierbaren linksventrikulären Unterstützungssysteme HeartMate II und HeartMate 3 von Abbott/Thoratec aufgrund von Vorkommnissen von Entrinsic Outflow Graft Obstruction (EOGO) durch äußere Kräfte bekannt. Dieser Rückruf betraf 13.883 Geräte, was 56% der Gesamtmarktprodukte ausmacht, mit einer Kaplan-Meier-geschätzten Auftretensrate von 0,24% in 2 Jahren und 2,06% in 5 Jahren für HeartMate 3 EOGO.
Die EOGO-Vorfälle bei HeartMate II und HeartMate 3 in diesem Rückruf sind in der Branche nicht neu. Bisher hat die FDA zahlreiche Berichte über unerwünschte Ereignisse im Zusammenhang mit EOGO bei HeartMate erhalten, insgesamt 273 Verletzungsereignisse und 14 Todesfälle.
Es ist bemerkenswert: Erstens bedeutet ein Class I-Rückruf der FDA für Medizinprodukte nicht das Ende der Produktion oder Nutzung des Produkts, sondern es werden Korrekturmaßnahmen für die identifizierten Probleme ergriffen, und die Geräte werden weiterhin in klinischen Umgebungen verwendet. Zweitens liegt der Grund für den Class I-Rückruf von HeartMate II und HeartMate 3 durch die FDA in EOGO, das durch die dichte PTFE-Materialverstärkungshülle von HeartMate II und HeartMate 3 verursacht wird, die zur Ansammlung von exsudiertem nicht-zellulärem Biomaterial führt und die künstliche Blutgefäßhülle nach innen drückt. Die inländischen LVAD-Geräte, die durch CH-VAD vertreten werden, haben die oben genannten Konstruktionsmängel von HeartMate durch das Hohldesign der Verstärkungshülle gelöst.
Die Magnetlagertechnologie ermöglicht eine stabile Rotation ohne flüssige Bedingungen, was die Blutschädigung erheblich reduziert und somit die Häufigkeit verwandter Komplikationen wie Thrombose und Schlaganfall verringert. CH-VAD erreicht eine stabile Schwebe in fünf Freiheitsgraden auf den X-, Y- und Z-Achsen durch die Anordnung des Motorstators und des Magnetlagerstators auf den inneren und äußeren Seiten des Rotors, was eine gute Stoßfestigkeit und einen stabilen Langzeitbetrieb gewährleistet und die Blutschädigung reduziert. Gleichzeitig sorgt das optimierte Strömungskanaldesign für einen reibungslosen Blutfluss vom Einlassrohr zur Laufradposition über einen Nasenkonus, mit einem U-förmigen Sekundärströmungskanal mit einem Spalt von 250μm, der sowohl einen reibungslosen Blutfluss als auch gute Spüleffekte gewährleistet.
Professor Zengsheng Chen von der Beihang-Universität betonte einmal, dass der "Übeltäter" dieses Rückrufs in der dichten PTFE-Materialverstärkungshülle von HeartMate II und HeartMate 3 liegt, während die inländischen LVAD-Geräte, die durch CH-VAD vertreten werden, das Problem der künstlichen Gefäßquetschung durch das Hohldesign der Verstärkungshülle gelöst haben.
Heutige VADs sind hochmoderne implantierbare Pumpen. Nehmen Sie zum Beispiel das CH-VAD. Es ist mit einem bemerkenswerten Laufrad ausgestattet, einem einzigen beweglichen Teil, das das Blut effizient in eine Richtung bewegt. Das Laufrad ist durch Magnete aufgehängt und arbeitet ohne Reibung und hat keine Komponenten, die anfällig für Verschleiß sind.
Laufräder spielen eine entscheidende Rolle in VADs. Wenn Strom durch die Magnete fließt, beginnt sich das Laufrad zu drehen. Blut wird unter Unterdruck in das Zentrum des Laufrads gezogen, und seine rotierenden Schaufeln beschleunigen das Blut schnell vom Zentrum zu den äußeren Rändern. Dieses transformierte Blut, jetzt unter Überdruck, fließt durch die Auslassdüse in die Ausflusskanüle aus der Pumpe.
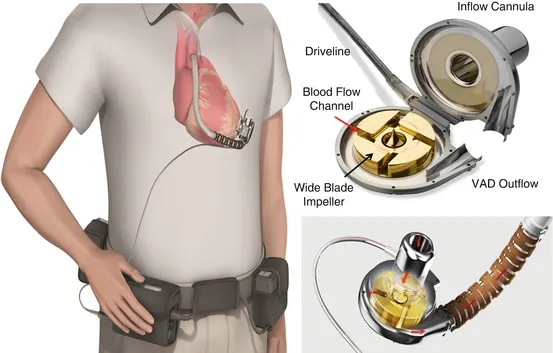
▲ Das Laufrad der Blutpumpe in VAD
Das Design des Laufrads ist von größter Bedeutung. Es wird durch Magnete und spezielle Lager an Ort und Stelle gehalten und dreht sich reibungslos, ohne die Seiten zu berühren. Dieses Design minimiert nicht nur die Schäden, sondern gewährleistet auch die Langlebigkeit des Geräts.
Bei Manners Technology spezialisieren wir uns auf die Herstellung von Teilen für medizinische Geräte, einschließlich Laufräder für VADs. Unser Engagement für Qualität wird durch unsere Zertifizierungen, einschließlich ISO 9001:2015 und ISO 13485, belegt.
Wir arbeiten auch mit einem führenden deutschen Unternehmen zusammen, um noch effizientere und zuverlässigere Laufräder für VADs zu entwickeln. Gemeinsam streben wir danach, Teile zu produzieren, die die Erwartungen übertreffen. Ob Sie spezialisierte Teile oder Unterstützung bei Entwürfen benötigen, unsere maßgeschneiderten Dienstleistungen sind darauf ausgerichtet, Ihren Bedürfnissen gerecht zu werden.